Rinnavähi personaliseeritud sõeluuringu mudel
Rinnavähk on jätkuvalt oluline rahvatervise probleem Eestis, olles 35–74-aastaste naiste seas kõige sagedasem vähkkasvaja ning vähist tingitud surma põhjus. Suremuse vähendamiseks on tõhusama ravi kõrval kaks olulist tegurit haiguse tõhusam ennetamine ja varasem avastamine.
Dr Hannes Jürgens, Tartu Ülikooli Kliinikumi arst-õppejõud
Kaasautorid:
MSc Katrin Lutsar, Tartu Ülikooli peremeditsiini ja rahvatervishoiu instituudi analüütik
Dr Vahur Valvere, Põhja-Eesti Regionaalhaigla onkoloog-ülemarst
Dr Krista Kruuv-Käo, estPerMed I konsortsiumi juht
Mammograafilisele sõeluuringule, millel on tõendatult rinnavähki suremust vähendav mõju, kutsutakse Eestis praegu naisi vanuses 50–69 eluaastat iga kahe aasta järel. Probleem on naiste vähene osalus selles – 50–56%, mis on oluliselt vähem kui tõhususe tagamiseks vajalik minimaalne 70%.
Sõeluuringu elupäästva mõju suurendamiseks võiks parandada sihtrühma ja ühiskonna teadlikkust veelgi ning täiendada kaasamise võimalusi. Lisaks võiks laiendada sihtrühma praegust vanusevahemikku ja muuta sõeluuring riskihinnangu alusel personaliseeritumaks. Sellest soovist ajendatuna korraldas estPerMed I konsortsium aastatel 2018–2021 Eestis rinnavähi teemalise pilootprojekti, milles osales üle tuhande geenidoonorist naise.
Kliiniline uuring
Kliiniline uuring oli disainitud rakendusuuringuna, et hinnata, kas geeniinfot saab kaasata rinna- ja munasarjavähi ennetuse ja varase avastamise parandamisesse. Geeniinfona kasutati päriliku rinna- ja munasarjavähi mõõduka ja suure riskiga geenide (BRCA1, BRCA2, TP53 jt) mutatsioonide esinemist ning polügeenseid riskiskoore (PRS). Uuringus kasutatud polügeense riski algoritmi töötasid välja ja valideerisid TÜ Eesti geenivaramus TÜ genoomika instituudi teadlased (K. Läll jt).
Suurema riskiga naissoost geenidoonoritele vanuses 22–79 aastat saadeti kutsed, milles paluti pöörduda onkoloogi või meditsiinigeneetiku konsultatsioonile. Seal nad said teavet oma geneetilise haigusriski kohta, neid nõustati ja neile tehti ka tervisekontroll.
Uuringu tulemusena võib öelda, et geeniinfot on võimalik kasutada rinna- ja munasarjavähi ennetuse ja varase avastamise parandamiseks, kuivõrd uuringu leiud kinnitavad selle tõhusust ja teostatavust ning uuritavatelt kogutud tagasiside kinnitab, et sihtrühm võttis sellise lähenemise hästi vastu.
Personaliseeritud sõeluuringu mudel
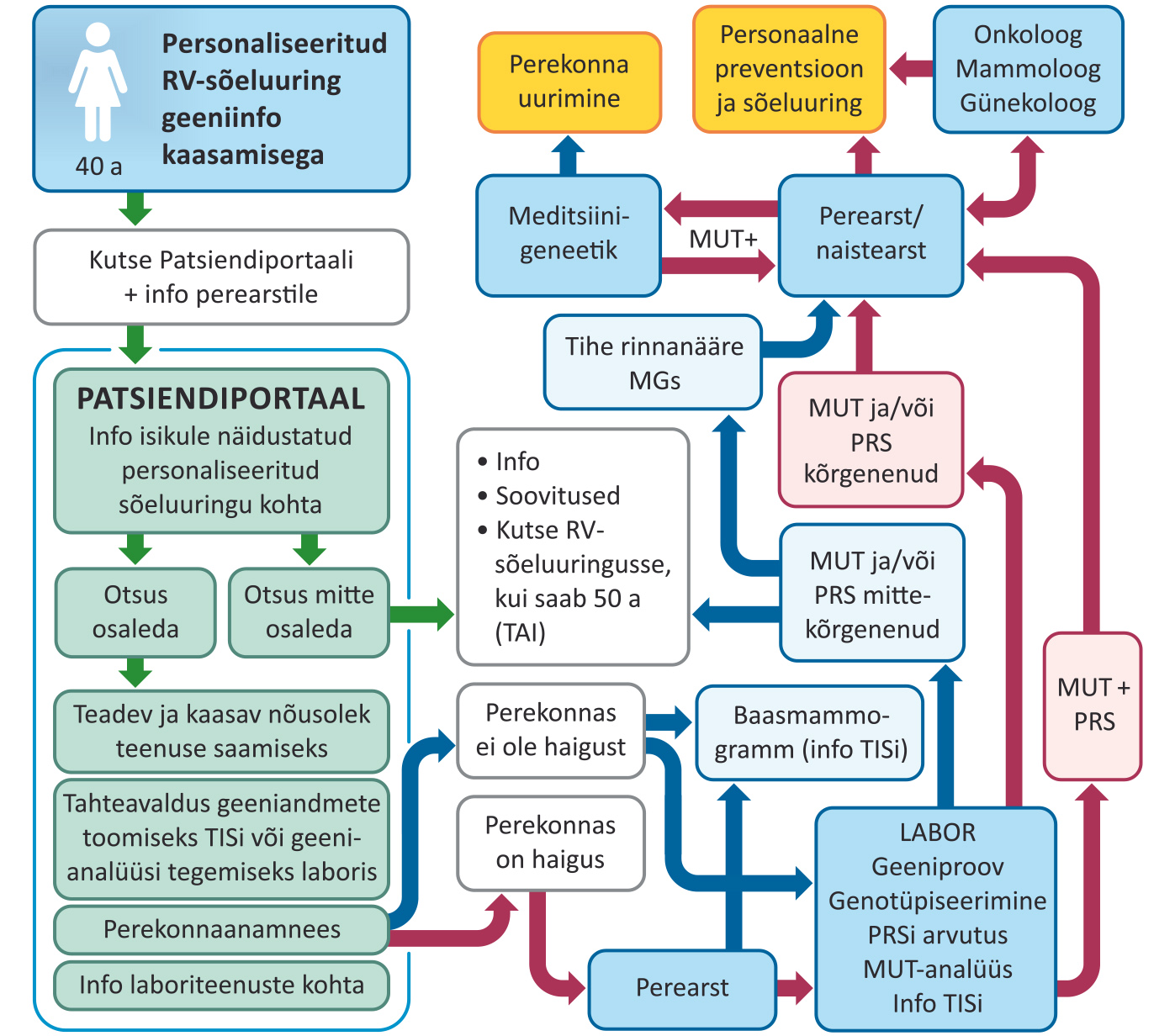
Konsortsium töötas uuringu käigus välja ka personaalset geneetilist eelsoodumust arvestava mudeli rinna- ja munasarjavähi õigeaegseks avastamiseks ja ennetamiseks ning hindas selle kulutõhusust Eestis rakendamise korral. Mudel on toodud skemaatiliselt joonisel 1.
MUT – monogeenne mutatsioon päriliku rinna- ja munasarjavähi geenis
MG – mammograafia
Joonis 1. Rinnavähi personaliseeritud sõeluuringus osalemise ettepanek 40-aastastele naistele
Rohelised nooled tähistavad isikute teekonda sõeluuringu kutse saamisest kuni patsiendiportaalis tervisedeklaratsiooni täitmiseni. Sinised nooled tähistavad tavapärase riskiga isikute ning punased nooled suurenenud riski kahtluse või riskiga isikute teekonda teenuse osutamisel.
Väljapakutud mudeli järgi kutsutaks kõik 40-aastaseks saavad naised geeniandmeid kaasavasse personaliseeritud sõeluuringusse. Teekonna alguses täidab teavitatud ja osalemisega nõustunud naine digitaalse tervisedeklaratsiooni, mille alusel täpsustub temale tehtav geenianalüüs: a) monogeensete mutatsioonide testimine ja PRS-i arvutus, kui pereanamneesis on vastavad leiud, või b) ainult PRS-i arvutus. Naine saadetakse baasmammograafiale, ja mutatsioonide testimise vajaduse selgumise korral ka perearstile ning laborisse.
Geenitesti ja tulevikus ka kõigi teiste oluliste riskitegurite hindamise alusel arvutatakse välja naise personaalne haigestumisrisk. Kõrgenenud riskitasemega naisi nõustatakse perearsti konsultatsioonil ja neile antakse edasised juhised, sh tuleb teha näidustuse ja naise teadliku nõusoleku korral kliiniline sekkumine sõeluuringuüksustes või eriarstide juures.
Otsustustoe süsteem annab arstile olenevalt patsiendi riskitasemest konkreetsed sekkumisjuhised, mida konsultatsioonil patsiendile selgitatakse. Näidustatud sekkumine salvestatakse tervise infosüsteemis ja seda näevad ka sõeluuringuüksused.
Koostöös sõeluuringut ellu viiva tervishoiuteenuse osutajaga rakendatakse patsiendile personaliseeritud rinnavähi preventsiooni ja varase avastamise programmi (tervisekäitumise soovitused, kliiniline rinnanäärmete kontroll, mammograafiline sõeluuring, vajaduse korral kemopreventsioon ja MRT). Suurenenud riskiga naisi jälgitakse kuni 74. eluaastani.
Mittesuurenenud haigusriskiga naistele antakse tagasisidet digitaalselt ja nad kutsutakse mammograafilisse sõeluuringusse 50-aastaseks saamisel.
Baasmammogrammi tegemine
Mammograafilisel uuringul mõõdetav rinnakoe tihedus on oluline nii rinnavähki haigestumise riski hindamisel kui ka edasiste mammograafiliste uuringute tegemise sageduse määramisel. Seetõttu peaks selle läbi tegema kõik sihtrühma naised, kes pole viimase paari aasta vältel mammograafilisel uuringul käinud. BI-RADS-i järgi (Breast Imaging-Reporting and Data System) C- ja D-astme tiheduse tuvastamise korral peaks naine pöörduma perearsti poole riski hindamiseks ja sobiva käsitluse valikuks.
Laboriteenused – geeniandmete saamine ja riskide väljaselgitamine
Kui naine on geenidoonor, ei ole tal tarvis anda uut geeniproovi. Ta saab teha digitaalselt tahteavalduse kanda andmed üle geenivaramust ja avaldada soovi personaliseeritud tervishoiuteenus (sh riski arvutusi) saamiseks. Kui naine ei ole geenidoonor, palutakse tal proovi andmiseks pöörduda laborisse.
Monogeensete mutatsioonide testimine
Kui naisele on olnud näidustatud monogeensete mutatsioonide testimine ja leitakse pärilik vähi monogeenne mutatsioon, siis suunab perearst ta esmaseks konsultatsiooniks (sh pereliikmete ülevaate koostamiseks ja kaskaaduuringuks) meditsiinigeneetiku juurde.
Personaalseks jälgimiseks ja sekkumiste, sh lisadiagnostika planeerimiseks suunab geneetik või perearst naise omakorda onkoloogi, günekoloogi või rinnavähiga tegeleva kirurgi juurde (mammoloog). Patsienti jälgitakse ja sekkumised tehakse raviasutuse käsitlusjuhendi kohaselt. Kui naisel monogeenseid haigust tekitavaid geenimutatsioone ei esine, tegutsetakse edasi PRS-i testi tulemuste alusel.
Meditsiiniliselt on naistel soovitatav pärilike monogeensete mutatsioonide testimine teha juba 25–30-aastaselt, mis on sageli patoloogiliste geenileidude korral varase avastamise meetmete, ennetavate sekkumiste kavandamise ja vähki haigestumise kasvu alguspiir. Ideaalis tuleks seda rakendada kogu vastavas vanuses naiste populatsioonile, et leida kõik päriliku mutatsiooni kandjad.
Isikliku ja perekondliku anamneesi põhjal selekteeritult testides jäävad hinnanguliselt enam kui pooled vähigeeni kandjad leidmata. Samas on kogu populatsiooni testimine praeguse tehnoloogia ja hindade juures veel sedavõrd kulukas, et võib viimase rakendamise otsustamisel määravaks saada. Pakutud personaalse ennetamise mudelisse sisenemine, sh PRS-i arvutused, toimuks kõigil patoloogilise geenileiuta naistel 40. eluaastal.
PRS-i test
PRS-i alusel mõõdukalt suurenenud riskiga rühma kuuluvate naiste esmast nõustamist (sõeluuringus osalemise kaasatud otsus, esmane rinnanäärmete kontroll) ja hilisemat jälgimist (kord aastas) teevad perearstid, kes suunavad naise ka 45. eluaasta täitumisel kemopreventsiooni konsultatsiooniks onkoloogi, günekoloogi või rinnavähiga tegeleva kirurgi juurde (mammoloog), kes jälgivad raviga soostunud naisi edasi kemopreventsiooni perioodil. Teise võimalusena juhib kogu protsessi günekoloog, kes nõustab, jälgib, rakendab sekkumisi ja vajaduse korral suunab edasi onkoloogi või mammoloogi juurde.
Rinnavähi risk ja sekkumisjuhised
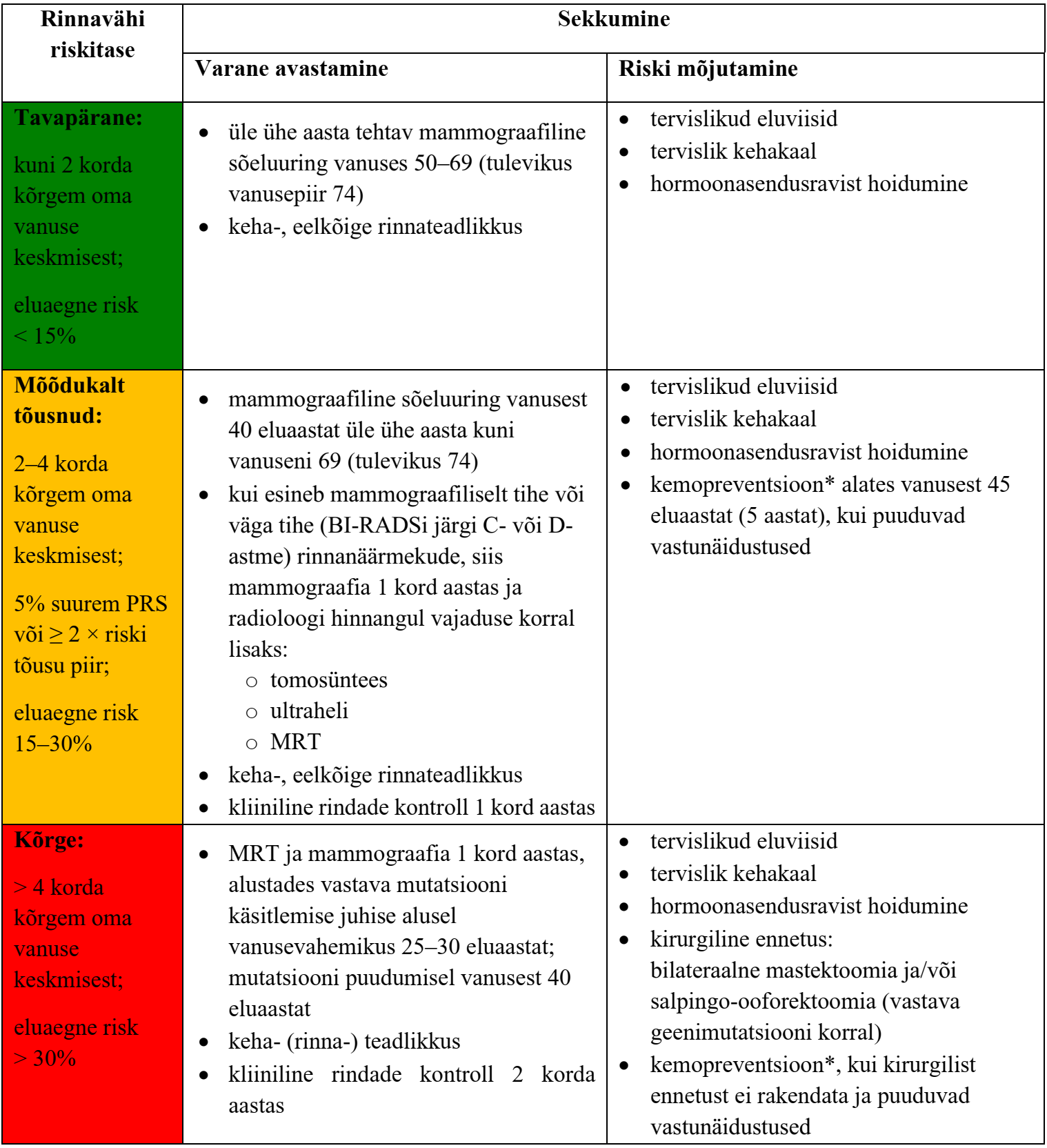
Rinnavähki haigestumise võimalikud riskitasemed ja sekkumised, arvestades Eesti haigestumusnäitajaid ja ka rahvusvaheliste organisatsioonide (NICE – National Institute for Health and Care Excellence Suurbritannias, NCCN – National Comprehensive Cancer Network Ameerika Ühendriikides) soovitusi, on esitatud tabelis 1.
Tabel 1. Riskitasemed ja vastavad sekkumised
* Kemopreventsioon – 5-aastane hormoonravikuur tamoksifeeniga (selektiivne östrogeenretseptori modulaator) premenopausis naistel; menopausis naistel 5 aastat hormoonravi aromataasi inhibiitoriga (anastrasool, letrosool). Oodatav kasu: hormoonretseptori suhtes positiivse rinnavähi tekkimise riski vähenemine: HR 0,66 (95% uv 0,54–0,81).
Jagatud otsuse vajalikkus ennetuse rakendamisel
Personaalse riski hindamiseks nõusoleku andmisel peab naine saama tasakaalustatud ja lihtsasti mõistetaval viisil (sh skemaatiliselt, visuaalselt) teavet selle otsusega kaasneda võiva kasu, aga ka kahju ja piirangute kohta. Kasu seisneb riskide teadasaamises ning kaasnevas nõustamises, nõustumisel ka ennetavate ja/või varase avastamise meetmete rakendamises vastavalt riski tasemele, mille eesmärk on vähendada vähki haigestumist ja avastada vähijuhud varem. See omakorda on seotud potentsiaalselt väiksemas mahus vähiraviga (rinda säästev operatsioon, pole keemiaravi vajadust) ja vähki suremise väiksema riskiga. Tulevikus, kui teadusuuringud kinnitavad selle lähenemise ohutust ja tõhusust, võib riskihindamine kasu tuua ka väiksema riskiga naistele, keda saaks jälgida tavapärasest harvemini ja/või hilisemas eas alustatava sõeluuringuga.
Riskihindamisega seotud kahju seisneb riskihindamise piiratuses (nt PRS test ei võimalda tuvastada ega välistada pärilike rinna- ja munasarjavähi geenimutatsioonide esinemist, samuti ei saa välistada vähi tekke võimalust riskitasemest sõltumatult) ning ebatäpsuses (geneetiline riskihinnang on arvutatud praeguse parima teadmise juures, kuid võib teadmiste lisandudes muutuda ja seda isegi olulisel määral – madalast kõrgeks ning PRS-i puhul ka vastupidi ehk suurest väikeseks). See on seotud hindamismeetodiga, mis muutub aja jooksul ja paraneb ühes teadmiste täienemisega, aga ka rahvastiku keskmise riski üldistamisega konkreetsele isikule.
Võimalikuks riskihindamisega seotud kahjuks võib pidada ka suurema riskiga naistel tavapärasest erinevalt rakendatavate uuringutega seotud probleeme: röntgenkiirgusest tingitud sekundaarsete kasvajate tekke riski suurenemine (vähene), MRT uuringul kasutatava kontrastaine võimalik kahjulik mõju (sh pikaajaline talletumine kudedes), valepositiivsed ja valenegatiivsed, aga ka ebaselged leiud, mis võivad viia asjatute lisauuringute ja üleravini, valenegatiivse leiu koral koguni vähi ravimata jätmisele. Samuti kaasnevad riskileiuga naistel soostumise korral kirurgilise sekkumise ja/või kemopreventsiooniga kaasneda võivad terviseriskid. Võrreldes naistega, kelle risk ei ole suurenenud, on kasu ja kahju suhe siiski parem.
Riskihinnangu teadasaamine võib põhjustada stressi, eriti keskmisest suurema riski korral. Selleks, et stressi vähendada, koolitatakse perearste, eriarste ja õdesid patsiente vastavalt nõustama.
Majanduslik põhjendatus
Pakutud rinna- ja munasarjavähi ennetuse mudeli rakendamise majandusliku mõju hindamiseks analüüsiti kliinilise uuringuga samal ajal ka kulutõhusust ja arvutati ennetuse rakendamise eelarve mõju. Kulutõhususe analüüsis hinnati ennetuse kulusid ja sellest saadavat kasu 40-aastaste naiste kohordis eluea (100. eluaastani) ning eelarve mõju analüüsis viie aasta perspektiivis. Eeldatav 40-aastaseks saavate naiste arv Eestis on lähiaastatel 8800 naist aastas.
Rinnavähi personaalse ennetusega kaasnevad võrreldes tavapraktikaga oluliselt suuremad geneetilise testimise ja ennetavate sekkumiste rakendamise kulud. Samas saavutatakse ennetusega kokkuhoid vähiravi kulude arvelt. Võit elueas saavutatakse ära hoitud surmajuhtude ja võit kvaliteetses elueas ära hoitud vähijuhtude arvelt. Pakutud mudeli alusel teenuse täiendkulu tõhususe määr (ICER) võrreldes tavapraktikaga on 5% diskontomäära juures 6889 eurot võidetud kvaliteetse eluaasta kohta, diskonteerimist rakendamata vaid 636 eurot kvaliteetse eluaasta kohta.
Kulutõhususe analüüsi tulemus sõltub eelkõige monogeensete mutatsioonide testimise ja PRS-i testi hinnast, mis võivad testimise mahu suurenemisel praegusega võrreldes muutuda oluliselt. Analüüsis kasutati Eesti kliinilises praktikas kasutatavaid monogeensete mutatsioonide testimise kulusid ning tehti eeldusi PRS-i hindamise tõenäolise kulu kohta. Kirjeldatud rinnavähi personaliseeritud ennetuse mudeli rakendamisel on lisanduv kulu praeguste hindade juures viie aasta perspektiivis võrreldes tavapraktikaga 4,6 mln eurot.
Post scriptum
Kirjeldatud mudel ei ole lõplik Eestis kasutusele võetav versioon. Viimane on väljatöötamisel, sõltub mitmete tegurite ja kaalutluste koosmõjust ning võib seega artiklis kajastatust erineda. Sõeluuringu mudeli muutmise tulemusena muutuvad tõenäoliselt ka ennetuse kogukulu, saadav kasu ning arvutatud kulutõhususe ja eelarve mõju hinnangud.