Polügeensete riskiskooride kasutamine kliinilises praktikas, 1. osa
2021. aasta jaanuaris andis Cambridge’i ülikooli juures tegutsev mõttekoda PHG Foundation välja ülevaate polügeensete riskiskooride (PRS-ide) kliinilisest rakendamisest. Ülevaate eesmärk oli selgitada PRS-ide olemust ja peamisi lahendamist vajavaid probleeme, et tagada PRS-ide kliinilisel rakendamisel maksimaalne kasu.
Ülevaate kokkuvõte on jagatud kaheks osaks, millest esimeses kirjeldame kliinilise kasu hindamist uute rakenduste puhul ning PRS-ide kasutusvõimalusi. Sügisel tutvustame ülevaates käsitletud PRS-ide valideerimist, mis on vajalik PRS-ide kliinilisse kasutusse toomiseks.
Polügeenne riskiskoor biomarkerina
Monogeenseid ehk vaid ühe geeni poolt mõjutatavaid pärilikke haigusi põhjustavad enamasti tugeva mõjuga harva esinevad geneetilised variandid. Nende esinemist määratakse laboris biomarkerina, et arst saaks panna diagnoosi või diagnoosi täpsustada.
Paljude geneetiliste muutuste poolt mõjutatud ehk polügeensete komplekshaiguste esinemise riski hindamiseks on aga vaja uurida väikese mõjuga ja rahvastikus sageli esinevaid paljusid geneetilisi variante. PRS ongi mehhanism, mida on võimalik kasutada biomarkerina mitme geneetilise variandi koosmõju hindamiseks.
PRS annab haiguse tõenäosusliku riski sarnaselt tavapäraste uuringutega, nagu kolesterooli või vererõhu määramine.
Kuna komplekshaiguste riski mõjutavad lisaks geneetilisele komponendile suuresti ka keskkonnategurid, sealhulgas elustiil, siis sõltub PRS-i rakendamise kliiniline kasu sellest, kui suur on geneetilise komponendi mõju kindla haiguse tekkele ja kui palju võimaldab PRS-i tulemus mõjutada edasisi kliinilisi ja tervishoiuotsuseid.
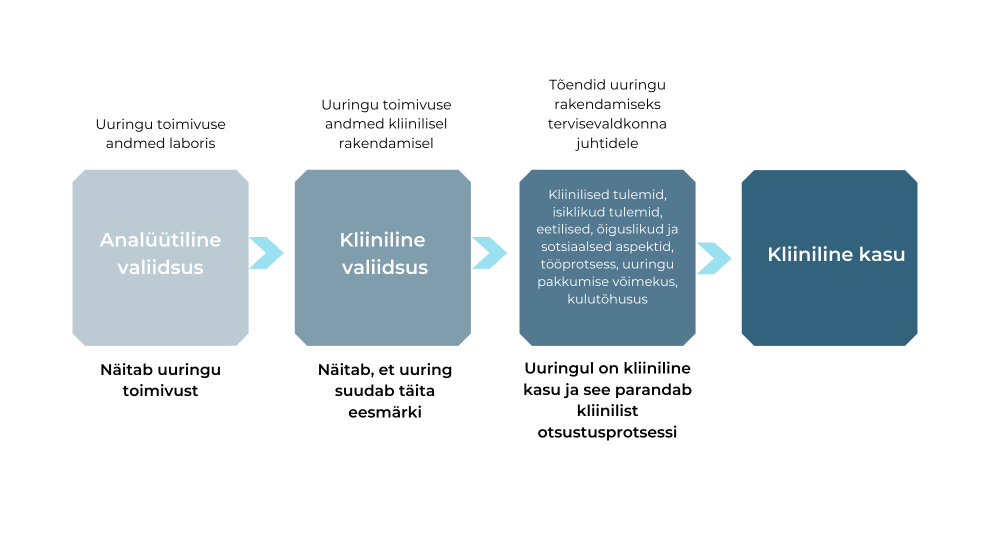
Mida tähendab uuringute kliiniline kasu?
Iga muudatus tervishoius eeldab selle kasu tõendamist.
Kliiniline kasu
Kliiniline kasu on lai mõiste uuringu kasulikkuse ja väärtuse kirjeldamiseks ning sellel pole üht konkreetset definitsiooni. Uus uuring peab vastama vajadusele, mille jaoks seni sobiv uuring puudus, või olema parem kui olemasolev uuring. Uuringu kasu avaldub ravi tulemuslikkuses, raviotsuste täpsustumises või töökorralduse parandamises.
Diagnostiliste uuringute kasu on otsene ehk uuringu tulemus võimaldab määrata diagnoosi, seevastu enamiku uuringute puhul see nii selge pole ja nendest saadav kasu on pigem kaudne (aitavad teha kliinilisi otsuseid, ent ei anna patsiendile kohest kasu). Näiteks haiguse tõenäosust ennustavad testid asümptomaatilistel indiviididel aitavad otsustada, milliseid ennetavaid meetmeid kasutada. Lisaks tuleb arvestada seda, mil viisil uuringu tulemusi tõlgendatakse ja milliseid eksperte selleks vajatakse. Seega koosneb uuringu kliiniline kasu kahest aspektist: uuringu eesmärgi täitmise võimekusest ja teostatavusest.
Klinitsist, patsient ja riik võivad oluliseks pidada erinevad vaatekohti. Klinitsistile on olulisim parandada ravi. Riiklikus tervishoius mõjutavad otsuseid riigi prioriteedid, kulutõhusus ning ka eetilised, juriidilised ja sotsiaalsed põhjused. Näiteks uuringute tulemused ei tohi põhjustada diskrimineerimist, häbimärgistamist või ohustada inimese privaatsust, perekonda või kogukonda. Nende aspektide tõenduspõhine hindamine on osa kliinilise kasu hindamisest ja vajalik enne uuringu rakendamist. Seetõttu ei pruugi ka kliiniliselt tõhusad lahendused alati kasutusse jõuda, kui osa ootustest on täitmata.
Isiklik kasu
Isiklik kasu on uuem termin, mis on esile tõusnud just geneetiliste uuringutega seoses. Ka selle kohta ei ole ühtset kokkulepitud definitsiooni. Isiklik kasu on individuaalne ning see põhineb individuaalsetel põhjustel ja testimise individuaalsel mõjul. Kuna tervis ja heaolu on holistilised kontseptsioonid, siis on isiklik kasu enamat kui testimisest tulenev mõõdetav kliiniline kasu. Sageli peetakse isiklikku kasu kliinilise kasu üheks osaks.
Isiklik vs. kliiniline kasu
Terminit „isiklik kasu“ kasutatakse vahel selliste uuringutulemuste kohta, millel ei ole kliinilist tähtsust (nt isaduse testimine).
Vahel on isiklik ja kliiniline kasu sama. Näiteks kuigi Huntigtoni tõvel ravi puudub, on nii positiivsel kui ka negatiivsel testi tulemusel individuaalsel tasandil psühholoogiline, sotsiaalne ja praktiline kasu ning ka kliiniline kasu.
Isiklik ja kliiniline kasu võivad aga ka suuresti erineda, näiteks otse tarbijale mõeldud geneetiliste testide eesmärk võib olla ainult teadmiste andmine teadmise pärast või uudishimu rahuldamine, ilma mingi kliinilise kasuta.
Seega sõltub nende kahe kontseptsiooni erinevus kontekstist ja on subjektiivne.
Kliinilise kasu hindamise vahend
Hindamisvahendid on tervishoiukorraldajatele olulised selleks, et teha tervisetehnoloogiate kohta tõenduspõhiseid otsuseid (ingl health technology assessment, HTA). Kõnealuses ülevaates tugineti PRS-ide rakendamise analüüsil hindamisvahenditele, mis on välja töötatud geneetiliste uuringute tarvis. Lisaks tervishoiukorraldajatele on hindamisvahendid juhisteks arendajatele, et hinnata näiteks lünki tõenduspõhisuse tagamises.
Kliiniliste geneetiliste uuringute hindamisvahendeid on mitmeid ja need ei erine oluliselt teiste biomarkerite hindamise vahenditest. Nende eesmärk on hinnata:
- kas uuring suudab täpselt ja usaldusväärselt määrata geneetilise variandi esinemist;
- kas uuring ennustab kliinilise kõrvalekalde olemasolu, puudumist või selle esinemise riski täpselt;
- uuringu tegemise positiivseid ja negatiivseid mõjusid;
- uuringu maksumus;
- uuringust saadava info kasulikkust.
Paljud raamistikud baseeruvad ACCE mudelil (hõlmab nelja hindamiskriteeriumit: analüütiline valiidsus, kliiniline valiidsus, kliiniline kasulikkus ning eetilised, õiguslikud ja sotsiaalsed tagajärjed) või HTA protsessil.
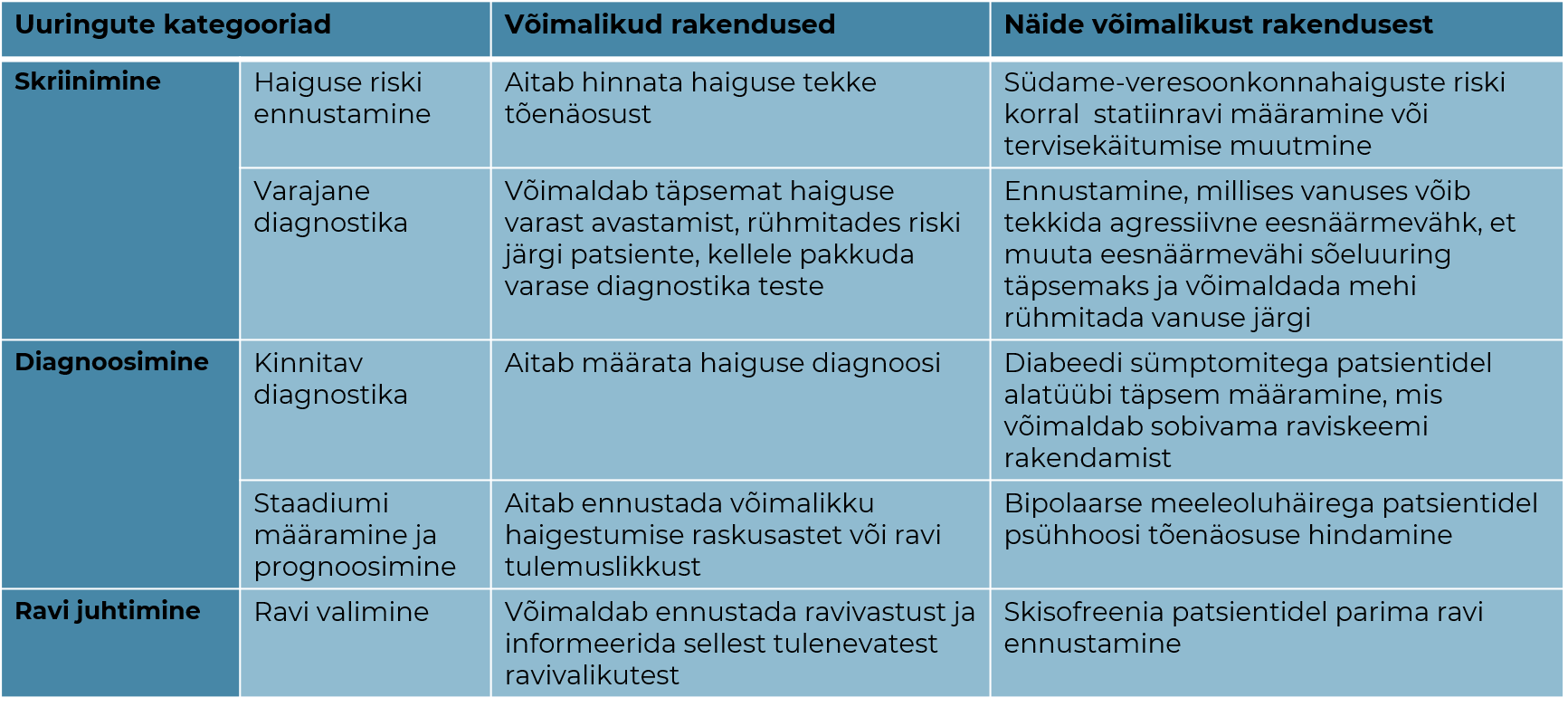
PRS-ide kasutamine kliinilises praktikas
PRS-ide kasu on seni hinnatud peamiselt teadusprojektides ja põhjalikke terviklike raviteekondade uuringuid on vähe. Seetõttu on PRS-ide rakendamise üle palju arutletud ja puudub konsensus, kas PRS-ide kliiniline kasu on piisav. Üksmeelel ollakse siiski selles, et PRS-id võivad tulevikus olla kliiniliselt kasulikud ja rakendatavad kliinilises praktikas (vt tabel 1) ja et:
- PRS-id ei erine oma olemuselt teistest biomarkeritest;
- PRS-ide puhul ei saa üldistada, kas need on kliiniliselt kasutatavad, vaid seda tuleb hinnata iga kasutusjuhu ja PRS-i arvutusmudeli korral eraldi;
- kliinilises praktikas kasutamiseks peavad PRS-id aitama langetada kliinilisi otsuseid;
- peab olema võimalik demonstreerida PRS-ide kliinilist kasu;
- juhuslikustatud uuringud on kliinilise kasu kindlakstegemiseks parim meetod, ent PRS-ide rakendatavuse uurimiseks ei pruugi see sageli teostatav olla;
- PRS-ide kasu on suurem, kui analüüsida tulemusi koos teiste biomarkeritega.
Senine arendustöö on keskendunud PRS-i mudelite arendamisele, kuid kliinilisse kasutusse võtmiseks tuleks korraldada kliinilisi uuringuid, mis põhinevad terviklike tervishoiuteenuste mudelitel ning mille puhul on defineeritud selge kliiniline kontekst ja sihtrühm.
Tabel 1. PRS-i erinevatel eesmärkidel kasutamise võimalused tervishoius.
Uuringute väljatöötamine
Peamine parameeter uuringu väljatöötamisel on selle sihtotstarve ehk teisisõnu see, millise eesmärgiga, millist markerit ja millisel sihtrühmal määratakse. Sihtotstarbest oleneb, mida tuleb valideerida. Eriti oluline on see siis, kui arendatakse platvorme, mis võimaldavad teha erinevaid uuringuid. Erinevalt ravimiarendusest ei ole uuringute arendamise puhul kirjeldatud kindlaid protsesse ja teekondi, kuna uuringud erinevad üksteisest olulisel määral – nii selle poolest, milleks, kui ka selle poolest, kuidas neid kasutatakse. Samuti sõltub arenduse protsess sellest, kas arendaja on labor, teadusasutus või nt uuringu tegemiseks vajalike reaktiivikomplektide tootja.
Valideerimise eesmärk on tagada uuringute usaldusväärsus, korratavus ja turvalisus ning selleks tuleb hinnata kasutatavust, kasusid ja riske. Valideerimise piisavust kontrollitakse regulatiivsetele nõuetele vastava hindamise käigus.
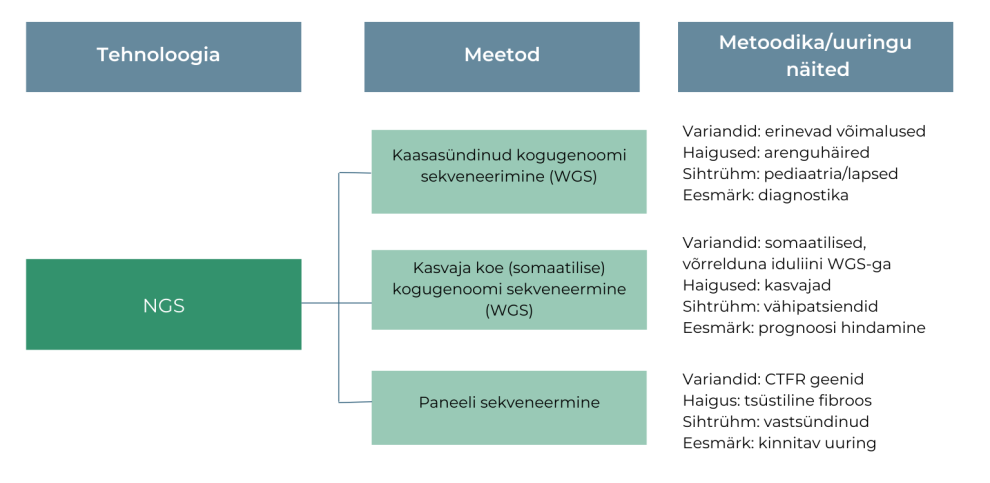
Uuringu sihtotstarvet aitab määrata tehnoloogia, meetodi ja metoodika eristamine (vt joonis 2).
Meetod on uuritava aine analüüsimine proovimaterjalis. Metoodika on meetodi kasutamine:
- kindla haiguse kontekstis;
- kindla sihtrühma puhul;
- kindla eesmärgiga.
Ühe tehnoloogilise platvormiga (NGS) on võimalik teha erinevate meetoditega (WGS) uuringuid. Metoodikad erinevad üksteisest eesmärgi poolest.
NGS – uue põlvkonna sekveneerimine (ingl next generation sequencing)
WGS – kogu genoomi sekveneerimine (ingl whole genoome sequencing)
CTFR – tsüstilise fibroosi transmembraanne regulaator (ingl truncated cystic fibrosis transmembrane conductance regulator)
Polügeensed riskimudelid, abivahendid ja metoodikad
PRS-e võiks kliiniliselt rakendada sarnaselt molekulaarsete analüüsidega. PRS-il põhinevaid ennustusmudeleid saab täpsustada teiste andmete lisamisega. Selliste mudelite kasutamise lihtsustamiseks on võimalik välja arendada terviklikud tööriistad, et kasutajad saaksid mugavalt lisada vajalikke andmeid ja näha tulemusi (nt QRISK ja CanRisk[1]).
Selliste tööriistade kasutamiseks peab sisendiks olev PRS-i väärtus olema arvutatud üksikisiku tasemel. See eeldab genotüpiseerimise, PRS-i mudeli ja arvutamise protsessi standardiseerimist. Tulemuste interpreteerimiseks on vaja teada PRS-i kui biomarkeri jaotust populatsioonis ning seose tugevust hinnatava omadusega.
Kui tervikliku riski arvutamiseks lisatakse ka kolesterooli, vererõhu vm andmeid, siis nimetatakse terviklikku riskimudelit kombineeritud riski mudeliks, mis on eraldi uuring. Kui kombineeritud riski arvutust soovitakse teha koos PRS-iga, võib kombineeritud uuring sisaldada ka PRS-i arvutust.
PHG Foundationi ülevaates esitatud PRS-ide valideerimise teemat kajastame septembri uudiskirjas.
Artikli refereeringu koostas TAI teadur Keiu Paapsi.