Kolmanda põlvkonna sekveneerimine muudab tipptasemel uuringud kättesaadavamaks
Esialgu üüratu maksumusega tehtud üksikute geenifragmentide sekveneerimistest on ligi poolesaja aastaga jõutud sekveneerimise kolmandasse põlvkonda, kus lubatakse täisgenoomil põhinevaid vastuseid juba tundidega ja oluliselt odavamalt. See avardab võimalusi uusimateks tervise- ja meditsiiniuuringuteks ka väga piiratud taristu ja rahaliste vahenditega riikides. Kuidas kolmandasse põlvkonda jõuti ja mis on selle hind ning lubadused?
Olli-Pekka Smolander, TAI personaalmeditsiini nõunik
DNA sekveneerimise meetodid töötati välja 1970. aastate lõpus. Professor Frederic Sanger (1981–2013) Cambridge’i ülikoolist ja tema kolleegid avaldasid 1977. aastal meetodi Sangeri sekveneerimiseks, mis oli de facto standard järgmiseks 30 aastaks. See avastus tõi talle teise Nobeli preemia (jagatud Walter Gilberti ja Paul Bergiga) keemia valdkonnas.
Esimese preemia sai ta insuliini aminohappelise järjestuse avastamise eest. Sangeri sekveneerimist on kasutatud laialdaselt nii teaduses kui ka meditsiinis kliiniliste leidude valideerimises ja üksikute haigustega seotud geenide uurimises.
Meetodit arendati edasi, et kasutada radioaktiivsete märgiste asemel fluorestsentsi. Tehnoloogilised edusammud suurendasid aastate jooksul läbilaskevõimet. Paraku ei saanud meetodit rakendada suurema hulga inimeste täisgenoomide sekveneerimiseks, sest see hõlmas ääretult töömahukaid ja aeganõudvaid etappe, näiteks DNA-materjali kloonimist bakteritesse amplifitseerimiseks.
Inimgenoomika ajastu algas 3-miljardilise projektiga
DNA sekveneerimist kasutati sel moel paljude mudelorganismide esimeste võrdluskvaliteediga genoomsete järjestuste tootmiseks. Tegu oli erakordse tööga, mis maksis üüratult palju. Üksikule projektile tänapäeval sellises mahus rahastust ei leiaks. Näiteks 1990. aastal alustatud Ameerika Ühendriikide riikliku terviseinstituudi projekti Human Genome Project eelarve oli 3 miljardit dollarit.
Projekt oli juba tollal ajendatud personaliseeritud ja genoomilise meditsiini ideest ning alustas sisuliselt inimgenoomika ajastut. Isegi Celera Corporationi peaaegu kümme aastat hiljem alustatud projekti eelarve oli endiselt 300 miljonit dollarit.
 Nendest kahest projektist pärinev inimese genoomi järjestus avaldati ametlikult 27. mail 2004. aastal, ja seda on hiljem uuendatud mitu korda. Kahjuks oli mõeldamatu, et niivõrd suur rahastamine oleks üksikute inimgenoomide sekveneerimiseks kättesaadav.
Nendest kahest projektist pärinev inimese genoomi järjestus avaldati ametlikult 27. mail 2004. aastal, ja seda on hiljem uuendatud mitu korda. Kahjuks oli mõeldamatu, et niivõrd suur rahastamine oleks üksikute inimgenoomide sekveneerimiseks kättesaadav.
Seetõttu piirdus sekveneerimine pikka aega genoomse DNA väga spetsiifiliste piirkondade uurimisega, näiteks teadaolevate vähiga seotud mutatsioonide uurimine genoomi konkreetsetes positsioonides või võrdlusgenoomide loomine, mis annaksid seejärel vajalikku teavet odavama, kuid piiratud kasutusvõimalustega DNA mikrokiibi metoodika kasutamiseks.
Lihtsamate analüüside jaoks kasutatakse DNA mikrokiipe ulatuslikult
DNA järjestuse teadaolevaid ja sageliesinevaid individuaalseid variatsioone on DNA-mikrokiibi tehnoloogia abil uuritud pikka aega. Tehnoloogia juured ulatuvad 1980. aastate algusesse, kuigi toona kasutatud kiibid olid tänapäevastest palju suuremad ja nende läbilaskevõime oluliselt väiksem. Kiibitehnoloogia põhineb lühikestel nukleotiidjärjestustel, mida nimetatakse sondideks – need on kinnitatud kiibi pinnale, moodustades teadaoleva struktuuri ja asukohaga klastrite võrgustiku.
Üksikute variantide uurimiseks kantakse proovist fragmenteeritud DNA kiibile, kus uuritava inimese DNA tükid hübridiseeruvad ainult neile vastavate sondide vastu. See protsess loob kiibile fluorestseeruvad punktid, mida saab skänneriga pildistada ja arvutitega analüüsida.
Tehnoloogia on küllaltki lihtne ja odav ning seda on aastate jooksul arendatud, et parandada tulemuste kvaliteeti ja läbilaskevõimet. Otse tarbijatele pakutavad geneetilised testid näiteks päritolu või sportliku sooritusvõime määramiseks (My Heritage, 23andMe vm) põhinevad peaaegu eranditult nendel DNA-kiipidel. Neid kasutatakse endiselt ka ulatuslikes teadusuuringutes ja kliinilises ning meditsiinilises töös.
Tehnoloogia põhineb etteantud sondidel ja hübridisatsioonil, seetõttu piirdub see pea mõnesaja tuhande teadaoleva genoomi positsiooni ja väikeste, ühe nukleotiidiga variantide uurimisega. See aga piirab tehnoloogia kasutamist ja rakendamist.
Valides uuritavad variandid õigesti, võib tehnoloogia pakkuda siiski teavet näiteks vähiriski alleelide kohta, anda teavet polügeense riskiskoori arvutamiseks ja küllaltki väikeste kuludega ka inimeste farmakogenoomiliseks hindamiseks. Uute variantide lisamisel on vaja kasutatud kiip ja sondid ümber kujundada ning uuesti valideerida. See võib olla aga aeganõudev ja kulukas ning hübridiseerimisel on alati ka tehnilised piirangud.
Suurem läbilaskevõime vähendas hinda oluliselt
Hübridisatsioonipõhiste mikrokiipide piirangud olid selged ja ka Sangeri sekveneerimise skaleeritavus jõudis oma piiridesse, seetõttu oli ilmselge vajadus sekveneerimistehnoloogia järele, mida saaks rakendada populatsiooni skaalal inimeste genoomide uurimiseks. Sellised tehnoloogiad töötati välja 1990. aastate teisel poolel ja 2000. aastate alguses.
Suure läbilaskevõimega sekveneerimise ehk järgmise põlvkonna sekveneerimise (ingl next generation sequencing, NGS) tõeline revolutsioon algas 2005. aastal, kui ettevõte nimega 454 tõi turule oma GS20 instrumendi. NGS-i lähenemisviis põhines lühematel lugemispikkustel, DNA-materjali kloonimiseta amplifikatsioonil ja rohkel paralleelseerimisel, mis võimaldas samal ajal sekveneerida miljoneid või praegu miljardeid DNA fragmente.
Tehnoloogilised ja teaduslikud edusammud molekulaarbioloogias, pildistamistehnoloogias, tootmistehnoloogias, arvutiteaduses ja muudes valdkondades võimaldasid sekveneerimismetoodikat ja -instrumente edasi arendada.
Läbilaskevõime on viimase kahekümne aasta jooksul suurenenud järsult ja nn short read tehnoloogiate tõttu on ühe inimese genoomi sekveneerimise hind vähenenud 1000 euro või dollarini.
See on võimaldanud viia ellu suuri riiklikke ja rahvusvahelisi sekveneerimisprojekte, mille tulemuseks on sadu tuhandeid sekveneerituid inimgenoome eesmärgiga ületada miljoni genoomi piiri. Sellised arengud on tekitanud olukorra, mil kitsaskoht on nihkunud sekveneerimiselt andmeanalüüsile ja kogutud info mõtestamisele.
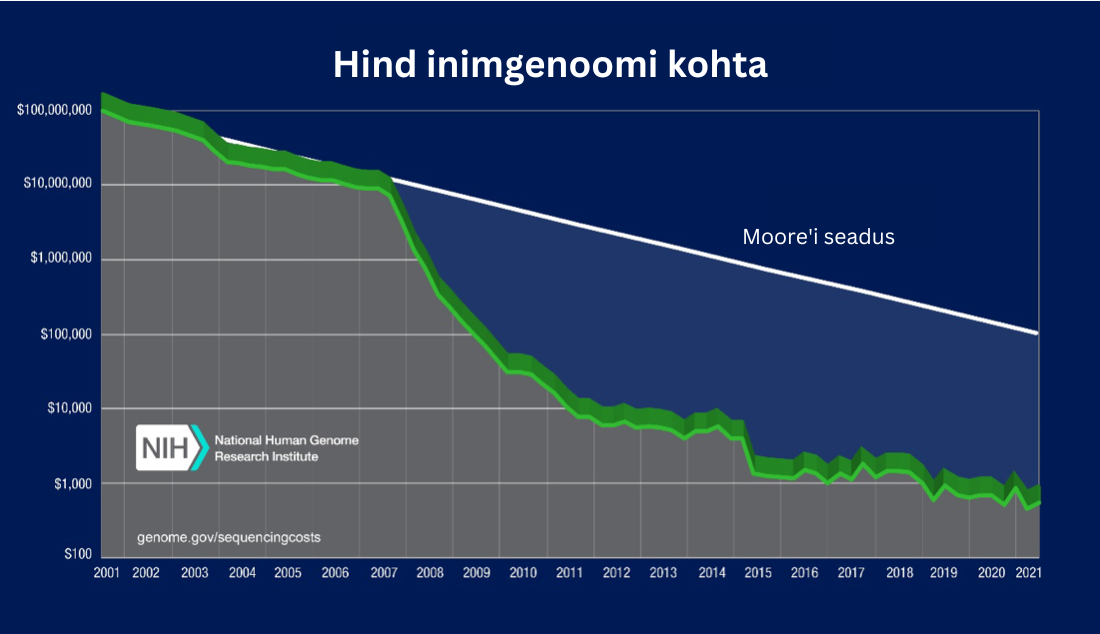
2007. aastal ostis Ameerika Ühendriikide biotehnoloogiaettevõte Illumina ära NGS-i sekveneerimist arendanud firma Solexa. Nende aastakümnete jooksul on ta arendanud sünteesipõhise sekveneerimise tehnoloogia NGS-i turul domineerivaks jõuks ja peaaegu de facto standardiks. Viimastel aastatel on pakkunud sellele suurt konkurentsi Hiina sekveneerimisettevõte ja instrumentide tootja MGI.
2022 – murranguline aasta tehnoloogias
Kuigi järkjärguline tehnoloogiline areng on parandanud sekveneerimise kasutatavust, toimus 2022. aastal palju suuri ja olulisi muutusi. Järjekordne tehnoloogilise arengu periood jõudis haripunkti ja Illumina ning tema konkurendid esitasid teadlastele mitmesuguseid instrumente ja andmeid.
Illumina lubab viia oma NovaSeq instrumendi uue versiooniga inimgenoomi sekveneerimise kulud vahemikku 200–300 eurot/dollarit ja sama lubab ka MGI. Teine Ameerika Ühendriikidest pärit firma Ultima Genomics lubas lükata piiri veelgi kaugemale – nende instrument peaks vähendama inimgenoomi sekveneerimise hinda 100 euroni.
Need arengud jätkuvad ka aastal 2023: veebruaris teatab Element Biosciences USA-st, et nende teistest pakkujatest väiksem seade, mis maksab umbes 300 000 dollarit, võimaldab sekveneerida inimese genoomi 200 dollariga. Sellise hinnaga saab korraldada suuri, populatsioonitasemel uuringuid ja võtta sekveneerimine tavakasutusse tervishoius ning kliinikus.

Kuigi sekveneerimine on üha odavam, juhib Tartu Ülikooli Kliinikumi geneetika ja personaalmeditsiini kliiniku juht Sander Pajusalu tähelepanu asjaolule, et kui kasutame sekveneerimistehnoloogiat kliiniliselt, on tegu tervishoiuteenusega. Tervishoiuteenus hõlmab aga oluliselt enamat kui ainult sekveneerimine, isegi kui see on piiratud või tegu on laborianalüüsiga.
Soodsam sekveneerimine mõjutab küll ka tervishoiuteenuse hinda, kuid arvesse tuleb võtta, et vastukaaluks suurenevad tööjõukulud (bioanalüütikud, kes proove ette valmistavad ja laborispetsilistid/arstid, kes analüüse interpreteerivad); andmete hoiustamise kulud, võttes arvesse üha mahukamaid andmeid; meid kõiki mõjutab energiahind jms.
Väga oluline kulu on ka meditsiinilabori kvaliteedisüsteemi tagamine, mis hõlmab nii kvaliteedi juhtimist kui ka näiteks osalemist rahvusvahelistes kvaliteedikontrolli ja akrediteerimisprogrammides. Seega, kui sekveneerimine maksaks isegi sada eurot, ei oleks see kindlasti tervishoiuteenuse hind.
Tervisekassa eriarstiabi osakonna peaspetsialist Tanel Kaju selgitab, et teenuste hinnastamisel lähtutakse Eestis tervishoiuteenuste osutajate tegelikest kuludest, kasutades tegevuspõhise kuluarvestuse meetodit. Kulukomponentide mahud igas teenuses kogutakse kokku ekspertarvamuste põhjal asjaomase eriala ekspertidest koosneva ühenduse alusel moodustatud töögrupi abiga, kulud aga referentsasutuste esitatud soetusmaksumuste järgi. Referentsasutustena kaasatakse kas neli kõige suuremat või need TTO-d, kes moodustavad vähemalt 70 protsenti teenuste mahust.
Alginvesteeringuks kulub sageli vähemalt miljon eurot
Uute instrumentide ja tehnoloogiate kulueeliste ärakasutamiseks tuleb teha oluline alginvesteering, mis ulatub miljoni euroni või rohkemgi, ning tagada tuleb ka pidev suure hulga proovide voog. Sekveneerimise läbilaskevõime nihe, millele järgnevad uued nõuded ümbritsevale infrastruktuurile ja proovide töötlemisele, tõstatab uusi, ka eetilisi vaatenurki.
Küsimus on näiteks seegi, kuidas tuleks rakendada inimproovide sekveneerimist nii teadusuuringutes kui ka kliinilistes tingimustes riiklikult või rahvusvaheliselt tehnoloogiliste edusammude hüvede jätkusuutlikuks lõikamiseks, tagades võrdsuse ja kaasatuse.
Samal ajal püüavad ettevõtted teha küllaltki suure läbilaskevõimega instrumendid kättesaadavaks väiksemate kapitalikuludega, võimaldades seega madalamat sekveneerimiskulu ka väiksemate seadmete puhul. Uued seadmed on energiatõhusamad ja kasutavad vähem reagente, olles seega ka jätkusuutlikumad.
Reagentide transporti püüavad teha jätkusuutlikumaks tootjadki, näiteks et ei oleks vaja kasutada kuivjääd. Võib öelda, et oleme jõudnud sekveneerimise demokratiseerumise ajastusse ja see areng hõlmab selliseidki sündmusi, mis lubavad tuua sekveneerimispõhised analüüsid laboritesse ja kohtadesse, mis varem tundusid selleks täiesti ebareaalsed.
Sander Pajusalu toob välja Euroopa Liidu suundumuse: võimaluse korral ei tohiks geeniandmed liikuda riigist välja, seega nähakse pigem, et kõigil riikidel on sekveneerimisvõimekus ja andmeid suudetakse ise hoiustada. Pajusalu leiab, et see on väga õige, sest geeniandmed on mitmelgi moel riiklikult strateegiline ressurss ja nende käitlemine peab alluma kohalikele regulatsioonidele.
Mõne aasta eest tundus, et kulude tõhustamiseks on ainus võimalus teha suuri rahvusvahelisi sekveneerimiskeskusi, aga viimased arengud ja uued platvormid on pigem toonud tagasi idee, et sekveneerimist saab teha igas riigis ja seda seejuures parima võimaliku kvaliteedi ja optimaalsete kuludega.
Jah, proovide arv on siiski oluline, sest kulutõhususeks ja analüüside mõistlike ringlusaegade tagamiseks on vaja suurt hulka proove. Seega on väga oluline tsentraliseerida geenitestimine Eesti-suuruses riigis paikselt, sest nii on tervishoiuressurss kasutatud tõhusamalt.
Kolmanda põlvkonna sekveneerimine
Paralleelselt NGS-i revolutsiooniga on teadus- ja tehnoloogiaringkond töötanud teistsuguse metoodika kallal – seda hakati nimetama kolmanda põlvkonna sekveneerimiseks.
Juba projekti algusajast on teada, et kogu inimgenoomi järjestuse, sh kõige keerulisemate alade, ja inimgenoomi kogu varieeruvuse spektri korrektseks uurimiseks on vaja teavet pikemate järjestusfragmentidena, näiteks mõne genoomi piirkonna korduvuse tõttu. Ammu on teada seegi, et teatud DNA piirkondi ei saa NGS-tehnoloogiatel põhinevaks järjestamiseks hästi ette valmistada (amplifitseerida). See aga paneb proovile NGS-meetodid, mis põhinevad DNA-fragmentide paljunemisel proovis.
Nende probleemide vältimiseks tuginevad 2000. aastate alguses välja töötatud kolmanda põlvkonna sekveneerimistehnoloogiad pikkadele amplifitseerimata DNA lõikudele. Kümnetest või sadadest tuhandetest aluspaaridest koosnevad üksikud DNA-molekulid sekveneeritakse paralleelselt, olenevalt tehnoloogiast, kas sekveneerimiskiipide külge kinnitatud üksikute DNA polümeraaside või poorimolekulide abil ning protsessi jälgitakse DNA järjestuse saamiseks. Viimase kümnendi jooksul on neid turustanud kaks ettevõtet – Pacific Biosciences USA-st ja Oxford Nanopore Ühendkuningriigist.
Nende tehnoloogiate esile kerkimine on muutnud võrdlusgenoomide tootmist. Aastal 2022, peaaegu 20 aastat pärast inimese genoomi esimest avaldamist, valmis viimaks rahvusvahelise T2T konsortsiumi täielikult telomeerist telomeerini (ehk ühest otsast teiseni) järjestatud genoom, välja arvatud Y-kromosoom. See võimaldab suuremat detailsust analüüsides, mis kasutavad lühikese lugemisega NGS-tehnoloogiat, aga ka uuringutes, mis kasutavad peamise teabeallikana 3. põlvkonna sekveneerimist.
Sekveneerimisaparaati saab kaasas kanda
2022. aasta tõi kaasa ka tehnoloogilised edusammud kolmanda põlvkonna sekveneerimises: mõlemad ettevõtted tutvustasid uusi instrumente PacBio Revio ja Oxford Nanopore P2, mis lubavad tarnida täielikke viitevabu individuaalseid inimgenoome hinnaga 1000 eurot/dollarit ning P2 kapitaliinvesteering alates 10 000 eurost. P2 on kaasaskantav seade, mida saab kasutada ka väljaspool tavalisi laboreid.
Sellised arengud on veel üks suur samm sekveneerimise demokratiseerimise suunas, sest võimaldavad tipptasemel meetodeid kasutada peaaegu kõikjal maailmas. Pealegi võrdsustab see võimalusi teha uusimaid tervise- ja meditsiiniuuringuid ning neis ka osaleda isegi väga piiratud rahaliste vahenditega riikides. See tõotab suurendada genoomika ja personaliseeritud meditsiini väga vajalikku mitmekesisust.
Murrangulist muutust rõhutab veelgi see, et need kolmanda põlvkonna meetodid võimaldavad näiteks vastsündinute või teiste kriitilises seisundis patsientide kliinilist sekveneerimist teha vaid mõne tunni jooksul pärast sündi või tuvastatud sümptomeid.
Ja kui eelmise põlvkonna tehnoloogiaga saab vaadata väikeseid muutusi, siis uue põlvkonna tehnoloogia võimaldab vaadata ka suuremaid muutusi ehk struktuurseid variatsioone, mis on kliiniliselt olulised ja mõjutavad suuremat osa meie genoomist.
Struktuurne variatsioon tähistab variante, nagu insertsioonid, deletsioonid, translokatsioonid ja duplikatsioonid, mis on suuremad kui NGS-meetoditega tuvastatud üksikute nukleotiidide muutused või väikesed insertsioonid ja deletsioonid. Struktuurne varieeruvus, mida lühemad lugemised ei tuvasta, põhjustab meie vahel rohkem DNA erinevusi kui väiksemad variandid kokku ja on osutunud ka kliiniliselt oluliseks.
Täielikuks läbimurdeks tuleb teha arendustööd
Sander Pajusalu sõnul ei ole kolmanda põlvkonna tehnoloogia end veel kliinilises meditsiinis tõestanud, võrreldes n-ö teise põlvkonna sekvenaatoritega (nt Illumina sekveneerimine). Ta toob probleemina välja sekveneerimise täpsuse ja läbilaskevõime. Kolmanda põlvkonna sekveneerimist (PacBio ja Nanopore) on inimeste geneetiliste haiguste uurimiseks kasutatud seni peamiselt teadusuuringutes ja teine põlvkond (lühikeste lugemitega sekveneerimine) on diagnostilises kasutuses praegu siiski veel kuldstandardiks.
Näiteks Nanopore tehnoloogiat on rohkem kasutatud hoopiski mikrobioloogia ja viroloogi laborites. Siiski rõhutab Pajusalu, et see ei tähenda, et tulevikus ei võiks kolmanda põlvkonna sekveneerimistehnoloogiad asendada praegust teist põlvkonda, kuid selleks tuleb teha olulist arendustööd ja kliinilist valideerimist.
Seega, kolmanda põlvkonna sekveneerimise tulevane lubadus on palju üksikasjalikum pilt inimese individuaalsetest genoomidest ja ülikiirest kliinilisest sekveneerimist, mis peaks muutuma kasutatavaks teabeks nii tervise kui ka meditsiinilistes sekkumistes.
