Bakteri immuunsüsteem aitab tulevikus muuta geene ja seeläbi ravida haigusi
Uudsel CRISPR-Cas9 genoomi kujundamise tehnoloogial on tohutu potentsiaal nii hingamisteede kui ka mitmete teiste haiguste ravis. Geene muuta võimaldav meetod on paljulubav, ent samas peidab endas suuri ohte.
Lisaks keskkondlikele teguritele mõjutavad respiratoorsete haiguste (astma, krooniline obstruktiivne kopsuhaigus, kopsuvähk, tsüstiline fibroos jt) kujunemist nii pärilikud kui ka epigeneetilised (muutused geeniekspressioonis, mis ei ole seotud muutustega DNA järjestuses) faktorid. Genoomika roll nende haiguste tekkes näitab, et meil on vaja paremat arusaama geneetilise varieeruvuse mõjust ja sellest, kuidas nendest muutustest üle saada, et edukamalt diagnoosida, ennetada ja ravida neid inimesi, kel on loetletud haiguste tekke risk.
Kui veel hiljuti oli ainsaks geenide muutmise tehnikaks ajakulukad ja kallid valkudel baseeruvad süsteemid, siis nüüd on teadlased loonud uue, RNA poolt juhitud geenide muutmise mehhanismi CRISPR (ing clustered regularly interspaced short palindromic repeats). Mehhanism, mis aitab bakterite immuunsüsteemil võidelda viirusinfektsioonidega, annab teadlastele võimaluse lülitada välja (ja hiljem asendada) patogeensete mutatsioonidega geene.
CRISPR-Cas9 süsteem sobib potentsiaalselt väga hästi ühe-geeni-haiguste raviks, näiteks tsüstiline fibroos, mil esinevad vead CFTR geenis. Süsteemi on juba katsetatud laboritingimustes, kus teadlastel õnnestus välja lülitada vigane CFTR geen ning asendada see uue ja funktsionaalsega.
Kuigi mehhanismil CRISPR-Cas9 on suur potentsiaal, kaasnevad selle rakendamisega ka ohud. Neist peamised on geeni muutmise täpsus (vale sihtmärk) ja efektiivsus, parandatud rakkude uuesti organismi viimine ning geenimuundamise soovimatute tagajärgede vältimine (nt DNA kahjustusele vastusena käivituv rakusurma mehhanism). CRISPR-Cas 9 peamiste rakendusaladena nähakse uute ravimite loomiseks vajalike mudelorganismide väljatöötamist ning genoomi muutvaid teraapiad, et ravida ühe geeni vigadest tingitud haiguseid.
Kuidas CRISPR-Cas9 mehhanism töötab?
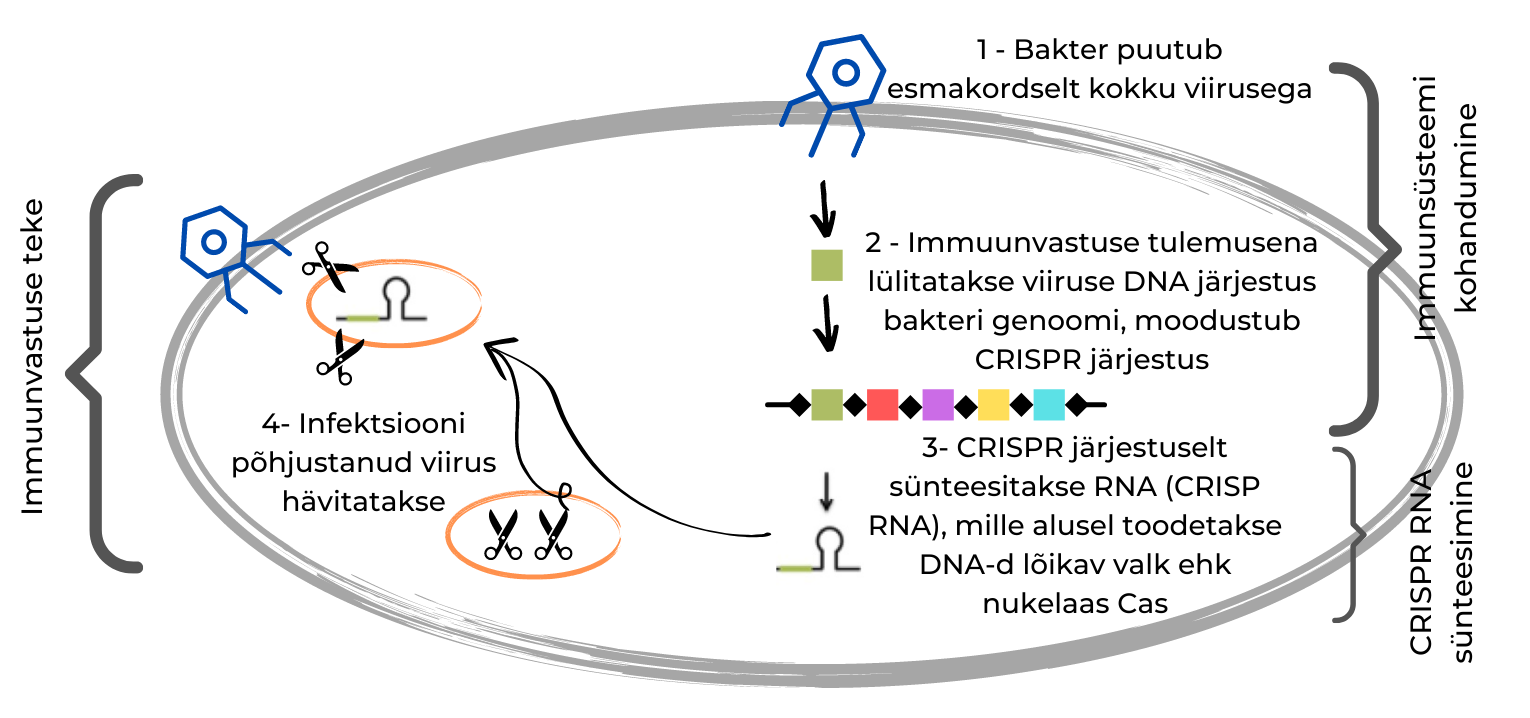
Bakteri genoomis olevad CRISPR järjestused eraldavad lühikesi viiruse DNA järjestusi, mis on bakteri genoomi sisestatud varasema viirusinfektsioonile tekkinud immuunvastuse tulemusena. Juhul kui bakter puutub sama viirusega uuesti kokku, siis uue nakatumise vältimiseks tehakse nendelt järjestustelt RNA, mida nimetatakse CRISP RNA-ks ehk crRNA-ks. crRNA omakorda kodeerib DNA-d lõikavat valku ehk nukleaasi (nimetatakse CRISPR-iga seotud valguks, ing CRISPR-associated protein ehk Cas). Toodetav nukleaas on seega eriomane just selle viiruse DNA-le ja on võimeline seda DNA-d lõikama, vältides nii viirusinfektsiooni teket.
Teadlased on kasutanud CRISPR-Cas süsteemi eukarüootsete genoomi muutmiseks, modifitseerides seda nii, et see sisaldaks üheahelalist RNA-d (ing single-guide RNA, sgRNA). sgRNA sisaldab järjestust, mis on komplementaarne sihtmärk DNA järjestusele (nt haigust põhjustava geeni DNA järjestus), seega juhib sgRNA nukleaasi sellele komplementaarsele DNA järjestusele, kutsudes esile viimase lõikamise. DNA lõikamine käivitab omakorda raku loomuliku DNA parandamise protsessid, mis on aga teadupoolest ebatäpsed ja põhjustavad parandatavas DNA-s vigu. Tekitatavate vigade tõttu lülitatakse raku poolt geen välja (silencing). Nii lõid teadlased obstruktiivse kopsuhaiguse uurimiseks vajaliku hiire mudelorganismi, kus lülitati välja SERPINA1 geen, sama geen, mis on inaktiivne sama haigust põdevatel patsientidel. Varem on seda olnud väga raske saavutada.
Allikad:
Vaughan A, Yang IA. CRISPR-Cas9 technology: A new direction for personalized medicine in respiratory disease? Respirology. 2019 Jul;24(7):614-615